工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表。
回答下列问题:
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的离子方程式为 。
(2)调节pH时不用氢氧化钠原因是: ,理论上,调节pH的最小值为 ,滤渣B的主要成分是 。
(3)加入MnS的目的是除去 杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为 。回收废旧碱性锰电池中的锰,可向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止,其主要反应为:2MnO(OH)+MnO2 +2H2C2O4 +3H2SO4=3MnSO4 +4CO2 ↑+6H2O,该方法的优点是 。
 以黄铁矿为原料生产硫酸的工艺流程图如下:
以黄铁矿为原料生产硫酸的工艺流程图如下: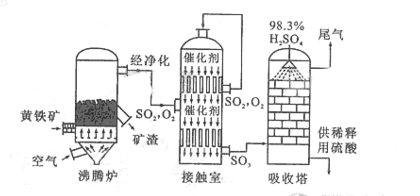
 化合放出260.6
的热量,该反应的热化学方程是。
化合放出260.6
的热量,该反应的热化学方程是。





 已知
、
和
三种元素的原子序数之和等于42。
元素原子的4
轨道上有3个未成对电子,
元素原子的最外层2
轨道上有2个未成对电子。
跟
可形成化合物
,
元素可以形成负一价离子。请回答下列问题:
已知
、
和
三种元素的原子序数之和等于42。
元素原子的4
轨道上有3个未成对电子,
元素原子的最外层2
轨道上有2个未成对电子。
跟
可形成化合物
,
元素可以形成负一价离子。请回答下列问题: 粤公网安备 44130202000953号
粤公网安备 44130202000953号