Ⅰ.某实验A小组设计生产亚氯酸钠(NaClO2)的主要流程如图,
已知NaClO2是一种强氧化性漂白剂,广泛用于纺织、印染工业。它在碱性环境中稳定存在。
(1)双氧水的电子式为 ,装置Ⅰ中发生反应的还原剂是 (填化学式)。
(2)A的化学式是 ,装置Ⅲ电解池中A在 极区产生,若装置Ⅲ中生成气体a为 11.2 L(标准状况),则理论上通过电解池的电量为 (已知法拉第常数F="9.65×l" 04C· mol-1)。
(3)装置Ⅱ中反应的离子方程式是 。
Ⅱ.某实验B小组测定金属锡合金样品的纯度(仅含少量锌和铜,组成均匀),将样品溶于足量盐酸: Sn+ 2HCl=SnCl2+H2↑,过滤,洗涤。将滤液和洗涤液合并再加过量的FeCl3溶液。最后可用一定浓度的K2Cr2O7酸性溶液滴定生成的Fe2+,此时还原产物为Cr3+。现有锡合金试样1.23g,经上述反应、操作后,共用去0.200mol/L的K2Cr2O7的酸性溶液15.00mL。
(4) 列式计算样品中锡的质量分数。
(5)用上述样品模拟工业上电解精炼锡,如图: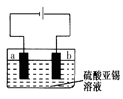
b极发生电极反应式 ,当得到11.90g纯锡时,电解质溶液质量减轻0.54g,则锡合金质量减少_______ g(结果保留一位小数)。
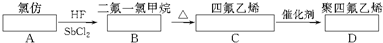
 ____Cu+____CuCl2+____N2↑+____H2O
____Cu+____CuCl2+____N2↑+____H2O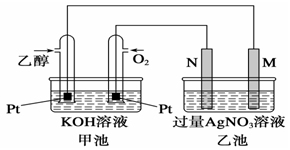
 粤公网安备 44130202000953号
粤公网安备 44130202000953号