实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的最佳物质的量之比为________ ;为了吸收该反应中产生的尾气,可选择的最佳装置是________(填序号)。
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计。
方案1:以空气为氧化剂。将铜粉在仪器N中反复灼烧,使铜与空气充分反应生成氧化铜,再使氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与烯硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,再通入空气或氧气,即发生反应,生成硫酸铜。反应完全后,加入物质甲调节pH,铁元素全部转化为Fe(OH)3沉淀(一般当铁离子的浓度下降到10-5mol·L-1时,就认为沉淀完全),然后过滤、浓缩、结晶。
(已知:常温下,Ksp[Cu(OH)2]=10-22,Ksp[Fe(OH)3]=10-38)
请回答下列问题:
①方案1中仪器N的名称是________。
②方案2中为了使铁元素全部沉淀,应调节pH至少为________。
③方案2中甲物质可选用________(填序号)。
| A.CaO | B.NaOH | C.CuCO3 | D.Cu2(OH)2CO3 E.Fe2(SO4)3 |
④方案2反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因:___________________________________________。

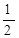 CaCO3+HNO3
CaCO3+HNO3

 粤公网安备 44130202000953号
粤公网安备 44130202000953号