按如图所示装置连接,X、Y均为惰性电极。请回答下列问题: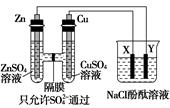
(1)Zn为________极。
(2)连接好装置后,烧杯中的溶液发生反应的离子方程式是___________。
(3)图中通过隔膜的SO42-向________(填“左”“右”或“不”)迁移,Y极及其附近出现的现象是________。
(4)常温下,当Zn极质量减少32.5 g时,X极生成气体8.4 L(标准状况),若此时烧杯中溶液的体积为500 mL,则此时烧杯中溶液的pH=________(不考虑生成的气体溶于水)。
按如图所示装置连接,X、Y均为惰性电极。请回答下列问题:
(1)Zn为________极。
(2)连接好装置后,烧杯中的溶液发生反应的离子方程式是___________。
(3)图中通过隔膜的SO42-向________(填“左”“右”或“不”)迁移,Y极及其附近出现的现象是________。
(4)常温下,当Zn极质量减少32.5 g时,X极生成气体8.4 L(标准状况),若此时烧杯中溶液的体积为500 mL,则此时烧杯中溶液的pH=________(不考虑生成的气体溶于水)。