食品安全是社会关注的热点。市场上已检测出一些矿泉水中含有高浓度的致癌物“溴酸盐”,而这个“行业秘密”在人们的眼皮底下被隐藏了10多年。实验室中制备“溴酸盐”过程如下: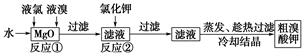
根据上述转化关系回答下列问题:
(1)反应①的化学方程式为______________________________。
(2)已知反应②是复分解反应,该反应的化学方程式为_____________________________。
(3)已知在酸性条件下溴酸盐可发生如下离子反应:
Ⅰ.2BrO3-+10Cl-+12H+=5Cl2↑+Br2+6H2O
Ⅱ.6BrO3-+5Cl-+6H+=5ClO3-+3Br2+3H2O
Ⅲ.BrO3-+5Br-+6H+=3Br2+3H2O
①上述反应所涉及的粒子中,氧化性最强的是________。
②在KCl和KBr的酸性混合溶液中,加入过量的KBrO3,其氧化产物为________,还原产物为________。
③将12 mL 0.4 mol·L-1 KBrO3溶液和10 mL 0.6 mol·L-1 KCl溶液在稀H2SO4中混合,充分反应后,产物KClO3和Cl2的物质的量之比为________。
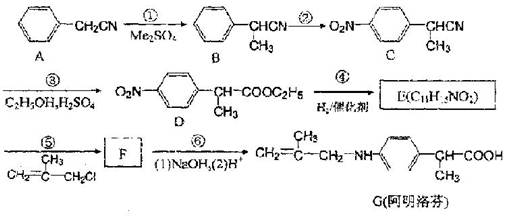
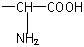 ,
,

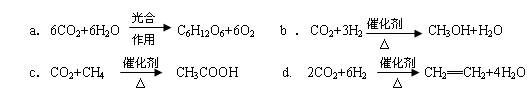
 CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
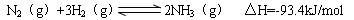

 粤公网安备 44130202000953号
粤公网安备 44130202000953号