从含有Ag+、Fe3+和Al3+的溶液中,按下图所示方法分离提取金属单质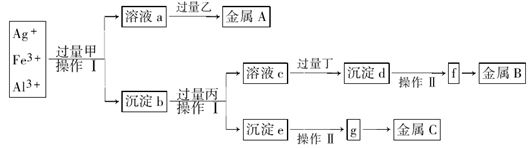
已知:实验时甲、乙、丙、丁四种物质只能从碳酸铵、氢氧化钠、稀硫酸、葡萄糖四种溶液中选择,也可用这四种溶液来制取。对该实验过程的分析正确的是
| A.丙是NaOH,丁是稀H2SO4 |
| B.乙是葡萄糖,利用乙的还原性将金属A从溶液a中还原出来 |
| C.操作I是过滤和洗涤沉淀。洗涤沉淀的方法是将漏斗中的沉淀转移到小烧杯中,加蒸馏水浸没沉淀,用玻璃棒搅拌,然后将水倒出,重复2-3次 |
| D.g是氧化物,金属c采用电解法获得 |
从含有Ag+、Fe3+和Al3+的溶液中,按下图所示方法分离提取金属单质
已知:实验时甲、乙、丙、丁四种物质只能从碳酸铵、氢氧化钠、稀硫酸、葡萄糖四种溶液中选择,也可用这四种溶液来制取。对该实验过程的分析正确的是
| A.丙是NaOH,丁是稀H2SO4 |
| B.乙是葡萄糖,利用乙的还原性将金属A从溶液a中还原出来 |
| C.操作I是过滤和洗涤沉淀。洗涤沉淀的方法是将漏斗中的沉淀转移到小烧杯中,加蒸馏水浸没沉淀,用玻璃棒搅拌,然后将水倒出,重复2-3次 |
| D.g是氧化物,金属c采用电解法获得 |