雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为______。
(2)上述反应中的氧化剂是______,反应产生的气体可用______吸收。
(3)As2S3和HNO3有如下反应: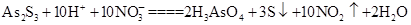 ,若生成2 mol H3AsO4,则反应中转移电子的物质的量为______。若将该反应设计成一原电池,则NO2应该在______(填“正极”或“负极”)附近逸出。
,若生成2 mol H3AsO4,则反应中转移电子的物质的量为______。若将该反应设计成一原电池,则NO2应该在______(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2 L O2(标准状况)混合后用水吸收全部转化成浓硝酸,然后与过量的C反应,所产生的CO2的量______(选填编号)。
a.小于0.5 mol
b.等于0.5 mol
c.大于0.5 mol
d.无法确定

 2H2O反应,设计成燃料电池,则负极通的应是 ,正极通的应是 ,电极反应式为: 、 。
2H2O反应,设计成燃料电池,则负极通的应是 ,正极通的应是 ,电极反应式为: 、 。
 2PbSO4 +2H2O。请依据上述情况判断:⑴铅蓄电池的负极材料是 。
2PbSO4 +2H2O。请依据上述情况判断:⑴铅蓄电池的负极材料是 。 粤公网安备 44130202000953号
粤公网安备 44130202000953号