(1)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①指出锌元素在周期表中的位置: 周期, 族, 区。
②NH3分子中氮原子的杂化轨道类型为 ,基态氮原子的核外电子排布式是 。 
③如图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为 ;该化合物的晶体熔点比干冰高得多,原因是 。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C—C的键长为154.45 pm,C60中C—C键长为140~145 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确 ,并阐述理由 。 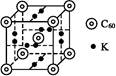
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如右图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。
③继C60后,科学家又合成了Si60、N60。C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
 2Na2O
2Na2O
 粤公网安备 44130202000953号
粤公网安备 44130202000953号