某化学小组为了证明SO2和Cl2的漂白性,设计了如下图所示的实验装置:
它们制备SO2和Cl2所依据的原理分别是:
Na2SO3+H2SO4= Na2SO4+H2O+SO2↑ MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)用来制取Cl2的装置是 (填序号),反应中浓盐酸所表现出的化学性质是 和
(2)反应开始一段时间后, B、D试管中的品红溶液均褪色。停止通气后,再给B、D两个试管分别加热,____ __ (填“B”或“D” )试管中无明显现象。
(3)装置C的作用是 ;
(4) 若装置D中的品红溶液换成紫色的石蕊溶液,则出现的现象是 。
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是 。
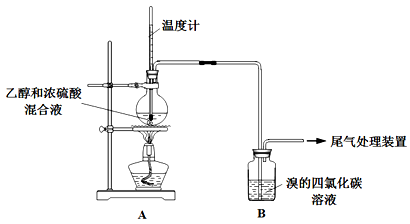

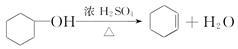
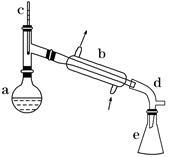

 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示。




 粤公网安备 44130202000953号
粤公网安备 44130202000953号