酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH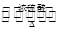 CH3COOC2H5+H2O。请根据要求回答下列问题:
CH3COOC2H5+H2O。请根据要求回答下列问题:
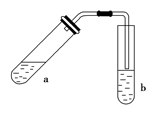
(1)试管a中需加入浓硫酸、冰醋酸和乙醇各2 mL,正确的加入顺序及操作是
________________________________________________________________________。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是
________________________________________________________________________。
(3)实验中加热试管a的目的是:①__________________;
②________________________________________________________________________。
(4)此反应以浓硫酸为催化剂,可能会造成____________、____________________等问题。
(5)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
同一反应时间
|
同一反应温度
|
反应温度/℃
|
转化率/%
|
选择性/%
|
反应时间/h
|
转化率/%
|
选择性/%
|
40
|
77.8
|
100
|
2
|
80.2
|
100
|
60
|
92.3
|
100
|
3
|
87.8
|
100
|
80
|
92.6
|
100
|
4
|
92.3
|
100
|
120
|
94.5
|
98.7
|
6
|
93.0
|
100
|
选择性100%表示反应生成的产物是乙酸乙酯和水
|
①根据表中数据,下列________(填字母)为该反应的最佳条件。
A.120 ℃,4 h B.80 ℃,2 h
C.60 ℃,4 h D.40 ℃,3 h
②当反应温度达到120 ℃时,反应选择性降低的原因可能为
________________________________________________________________________。