[化学—选修有机化学基础] (15分)
中药莲花清瘟胶囊是治疗甲型H1N1流感的有效药物,连翘是其主要成分之一,芳香族化合物X是合成连翘的有效成分连翘酯苷的中间体。
已知:
①X的相对分子质量180,碳的质量分数为60%,氢为4.45%,其余为氧;
②1mol X最多能与3mol NaOH反应,且X能与NaHCO3反应产生CO2气体;
③X遇FeCl3发生显色反应;
④经红外光谱分析X分子中含有碳碳双键。
请回答下列问题:
(1)X的分子式为,X中含有的官能团的结构简式为。
(2)X可发生的反应有。
| A.取代反应 |
B.加聚反应 |
C.水解反应 |
D.银镜反应 E.酯化反应 |
(3)X分子中苯环上两个相同的取代基相邻,与另一种取代基不相邻,核磁共振氢谱表明有8种氢原子,则其结构简式为。
(4)X与足量的浓溴水反应的化学方程式为。
(5)有机物Y与X互为同分异构体,请写出符合下列条件的Y结构简式。
①Y的苯环上有三个互不相邻的取代基,遇FeCl3不发生显色反应,不与NaHCO3反应,但能与Na反应生成H2;
②1mol Y最多能与4mol Ag(NH3)2OH发生银镜反应;
③在一定条件下,1mol Y最多与2mol NaOH反应。
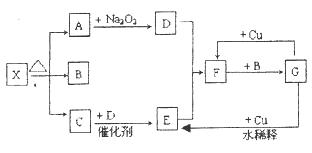

 、
、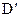 而得不到
而得不到 、
、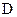 :
:
 溶液发生显色反应,写出符合条件的由X→
溶液发生显色反应,写出符合条件的由X→

 粤公网安备 44130202000953号
粤公网安备 44130202000953号