下图是有关二氧化硫性质的实验装置图,实验时C装置中溴水溶液退色。试回答下列问题: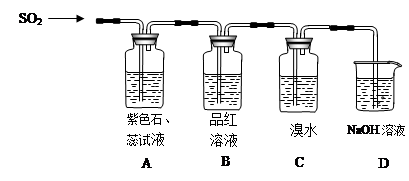
(1)A装置中的现象是 , B装置中的现象是 。
(2)二氧化硫具有:①漂白性 ②酸性氧化物性质 ③还原性 ④氧化性,在图中几个装置中对应表现出的性质是:A中 ;B中 ;C中 (填序号)。
(3)D中NaOH溶液的作用是 。
下图是有关二氧化硫性质的实验装置图,实验时C装置中溴水溶液退色。试回答下列问题:
(1)A装置中的现象是 , B装置中的现象是 。
(2)二氧化硫具有:①漂白性 ②酸性氧化物性质 ③还原性 ④氧化性,在图中几个装置中对应表现出的性质是:A中 ;B中 ;C中 (填序号)。
(3)D中NaOH溶液的作用是 。