在下列各变化中,反应①为常温下的反应,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体。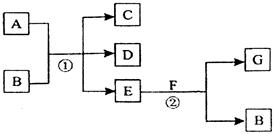
回答下列问题:
(1)A、G的化学式分别为___ 、___ 。
(2)A和E反应的化学方程式为__ 。
(3)写出反应①的化学方程式_____________。
(4)在反应②中,每生成2.24 L气体G(标准状况)时,消耗F _ ___g。
在下列各变化中,反应①为常温下的反应,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体。
回答下列问题:
(1)A、G的化学式分别为___ 、___ 。
(2)A和E反应的化学方程式为__ 。
(3)写出反应①的化学方程式_____________。
(4)在反应②中,每生成2.24 L气体G(标准状况)时,消耗F _ ___g。