对于A(g)+B(g) 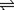 xC(g) ΔH 有:
xC(g) ΔH 有:
(1)①图表明P1 P2 ,且x的值为 ;
(2)②图表明T1 T2 ,且ΔH 0;
(3)如果③图R1,R2分别表示改变压强,则R1 R2 ,x的值为 ;
(4)如果③图分别表示有无催化剂,则R1表示 催化剂。
对于A(g)+B(g) 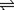 xC(g) ΔH 有:
xC(g) ΔH 有:
(1)①图表明P1 P2 ,且x的值为 ;
(2)②图表明T1 T2 ,且ΔH 0;
(3)如果③图R1,R2分别表示改变压强,则R1 R2 ,x的值为 ;
(4)如果③图分别表示有无催化剂,则R1表示 催化剂。