A是合成天然橡胶的单体,分子式为C5H8。A的一系列反应如下(部分反应条件省略):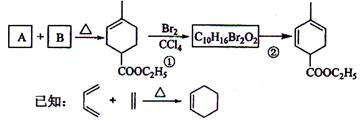
回答下列问题:
(1)A的名称是 ;B的结构简式为 。
(2)②的反应方程式为 。
(3)A的同分异构体中属于炔烃的异构体有 种。
(4)A、B反应还可以生成一个六元环化合物的结构简式为 。
A是合成天然橡胶的单体,分子式为C5H8。A的一系列反应如下(部分反应条件省略):
回答下列问题:
(1)A的名称是 ;B的结构简式为 。
(2)②的反应方程式为 。
(3)A的同分异构体中属于炔烃的异构体有 种。
(4)A、B反应还可以生成一个六元环化合物的结构简式为 。