近年来,由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视。某研究小组利用反应:CO(g)+H2O(g) H2(g)+CO2(g)△H=-41.2kJ/mol ,制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
H2(g)+CO2(g)△H=-41.2kJ/mol ,制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
(1) 已知:850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图1所示:
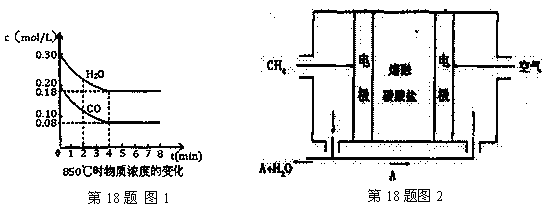
下列说法正确的是(填序号)
| A.达到平衡时,氢气的物质的量是0.12mol |
| B.达到平衡时,反应体系最终会放出49.44kJ热量 |
| C.在0—4min,混合气体的平均相对分子质量增大 |
| D.第6min时,若升高温度,反应平衡常数会减小 |
E.第8min时,若充入氦气,会导致v正(CO)<v逆(H2O)
(2) 850 ℃时,若在容积为2 L的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2。若要使上述反应开始时向正反应方向进行,则x应满足的条件是。
(3) 如将H2与CO2以4:1的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g)+2O2(g)=CO2(g)+ 2H2O(l) ΔH1=-890.3 kJ/mol
H2(g)+1/2O2(g)=H2O(l) ΔH2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是。
(4) 熔融盐燃料电池(见图2)是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是CH4 +4CO32--8e-=5CO2+2H2O。正极的电极反应是________。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环,则A物质的化学式是_________。实验过程中,若通入了标准状况下空气448 L(假设空气中O2体积分数为20%),则熔融盐燃料电池消耗标准状况下CH4____________L。