工业制备氯化铜时,将浓盐酸用蒸气加热至80 ℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步除去Fe2+,能否直接调整溶液pH=9.6,将Fe2+沉淀除去? ,(填“能” 或“不能”)理由是 ,
(2)有人用强氧化剂NaClO先将Fe2+氧化为Fe3+,再调整溶液的PH将Fe3+沉淀除去:
①加入NaClO后,溶液的pH变化是________(填代号)。
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当? ,(填“是” 或“否”)现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有________(有几个选几个,填代号)。
A.浓HNO3 B.Cl2 C.KMnO4 D.H2O2
(3)加入适当物质调整溶液pH,使Fe3+转化为Fe(OH)3沉淀,可以达到除去Fe3+而不损失CuCl2的目的,则调整溶液pH可选用下列物质中的___________。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
 极(填写正、负极)相连。
极(填写正、负极)相连。
 2
2 CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。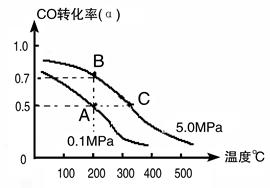
 粤公网安备 44130202000953号
粤公网安备 44130202000953号