甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业生产甲醇的常用方法是:CO(g)+2H2(g)  CH3OH(g) △H = —90.8kJ/mol。
CH3OH(g) △H = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H = —571.6kJ/mol;
H2(g)+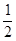 O2(g)=H2O(g) △H = —241.8kJ/mol;
O2(g)=H2O(g) △H = —241.8kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H = —566.0kJ/mol
CH3OH(g) = CH3OH(l) △H = —37.3kJ/mol
①计算液体CH3OH的燃烧热为 。
②若在恒温恒容的容器内进行反应CO(g)+2H2(g)  CH3OH(g),下列表示该反应达到平衡状态的标志有 (填字母序号)。
CH3OH(g),下列表示该反应达到平衡状态的标志有 (填字母序号)。
| A.有1个H—H键生成的同时有 3个C—H键生成 |
| B.CO百分含量保持不变 |
| C.容器中混合气体的压强不变化 |
| D.容器中混合气体的密度不变化 |
(2)制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g)  H2(g)+ CO2(g) △H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,试回答下列问题:
H2(g)+ CO2(g) △H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,试回答下列问题:
①该温度下,反应进行一阶段时间后,测得H2的浓度为0.5mol•L-1,则此时该反应v(正) v(逆)(填“>”、“<”或“=”);
②若反应温度不变,达到平衡后,H2O的转化率为 。
(3)某实验小组设计了如右图7所示的甲醇燃料电池装置。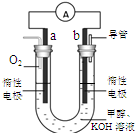
①该电池工作时,OH— 向 极移动(填“a”或“b”);
②工作一段时间后,测得溶液的pH减小,该电池负极反应的离子方程式为 。
 2SO3.5min后达到平衡,测得容器中有SO31.6mol.
2SO3.5min后达到平衡,测得容器中有SO31.6mol. ③白磷④氯气⑤
③白磷④氯气⑤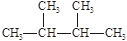
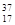 Cl⑦
Cl⑦ Cl⑧红磷
Cl⑧红磷 粤公网安备 44130202000953号
粤公网安备 44130202000953号