某混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH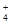 、Ba2+、Cl-、CO32-、SO42-。
、Ba2+、Cl-、CO32-、SO42-。
现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.36g;
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g。根据上述实验事实,以下推测中正确的是
| A.一定不存在Ba2+,可能存在NH4+ |
| B.不可能存在Ba2+、Cl- |
| C.Na+一定存在,且c(Na+)≥0.2 mol/L |
| D.Na+、Cl-可能存在 |
某混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH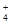 、Ba2+、Cl-、CO32-、SO42-。
、Ba2+、Cl-、CO32-、SO42-。
现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.36g;
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g。根据上述实验事实,以下推测中正确的是
| A.一定不存在Ba2+,可能存在NH4+ |
| B.不可能存在Ba2+、Cl- |
| C.Na+一定存在,且c(Na+)≥0.2 mol/L |
| D.Na+、Cl-可能存在 |