甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g) CO(g)+3H2(g) △H=+206.0kJ•molˉ1
CO(g)+3H2(g) △H=+206.0kJ•molˉ1
II:CO(g)+2H2(g) CH3OH(g) △H=-129.0kJ•molˉ1
CH3OH(g) △H=-129.0kJ•molˉ1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为 。
(2)将1.0mol CH4和1.0mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图。
①假设100℃时达到平衡所需构时间为5min,则用H2表示该反应的平均反应速率为 。
②1000C时反应I的平衡常数为 。
(3)在压强为0.1 MPa、温度为300℃条件下,将a molCO与2a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器舶容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
| A.平衡常数K增大 | B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH的物质的量增加 | D.重新平衡c(H2)/c(CH3OH)减小 |
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将CO2+氧化成CO3+,然后以CO3+做氧化剂再把水中的甲醇氧化成CO2而净化。若下图装置中的电源为甲醇-空气-KOH溶液的燃料电池,则电池正极的电极反应式: ,该电池工作时,溶液中的OHˉ向 极移动。净化含1mol甲醇的水,燃料电池转移电子 mol。
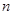 的透明物质做成内、外径分别为
的透明物质做成内、外径分别为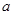 、
、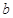 的球壳,球壳的内表面涂有能完全吸收光的物质,如图所示,当一束平行光从左侧射向该球壳时,被吸收掉的光束在射进球壳左侧外表面前的横截面积有多大?
的球壳,球壳的内表面涂有能完全吸收光的物质,如图所示,当一束平行光从左侧射向该球壳时,被吸收掉的光束在射进球壳左侧外表面前的横截面积有多大?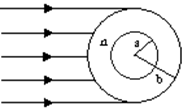
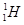 )轰击固态的重水
)轰击固态的重水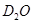 ,当质子和重水中的氘核(
,当质子和重水中的氘核(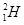 )发生碰撞时,系统损失的动能如果达到核反应所需的能量,将发生生成
)发生碰撞时,系统损失的动能如果达到核反应所需的能量,将发生生成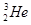 核的反应。
核的反应。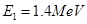 时,用质子流轰击固态的重水
时,用质子流轰击固态的重水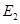 。已知氘核质量等于质子质量的两倍。
。已知氘核质量等于质子质量的两倍。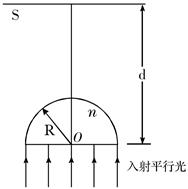
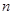 ,求出圆形亮区的最大半径。
,求出圆形亮区的最大半径。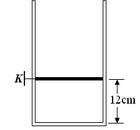
 ,第一四象限有磁场,方向垂直于Oxy平面向里。位于极板左侧的粒子源沿x轴间右连续发射质量为m、电量为+q、速度相同、重力不计的带电粒子在0~3t0时间内两板间加上如图乙所示的电压(不考虑极边缘的影响)。已知t=0时刻进入两板间的带电粒子恰好在t0时刻经极板边缘射入磁场。上述m、q、
,第一四象限有磁场,方向垂直于Oxy平面向里。位于极板左侧的粒子源沿x轴间右连续发射质量为m、电量为+q、速度相同、重力不计的带电粒子在0~3t0时间内两板间加上如图乙所示的电压(不考虑极边缘的影响)。已知t=0时刻进入两板间的带电粒子恰好在t0时刻经极板边缘射入磁场。上述m、q、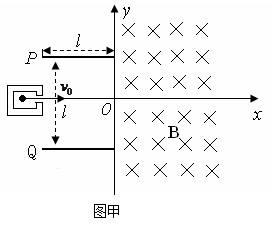
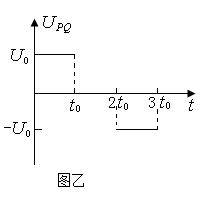
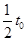 时进入两板间的带电粒子在磁场中做圆周运动的半径。
时进入两板间的带电粒子在磁场中做圆周运动的半径。 粤公网安备 44130202000953号
粤公网安备 44130202000953号