工业上在催化剂作用下可利用CO合成甲醇:CO(g)+2H2(g) CH3OH(g),图1表示反应过程中能量的变化情况。
CH3OH(g),图1表示反应过程中能量的变化情况。
请回答下列问题:
(1)在图I中,曲线______(填“a”或“b”)表示使用了催化剂;该反应属于______(填“吸热”或“放热”)反应。
(2)为探究外界条件对合成甲醇化学反应速率的影响规律,某科技工作者设计了以下三组实验,部分数据已填人表中,请补充完整。
| 实验组 |
T/℃ |
起始浓度/mol•L-1 |
等质量催化剂的 比表面积/m2•g-1 |
|
| CO |
H2 |
|||
| ① |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
| ② |
280 |
1.20×10-3 |
5.80×10-3 |
124 |
| ③ |
350 |
|
|
124 |
其中设计实验组①和②的目的是______。
(3)“图2”所揭示的规律是:在p1压强达平衡时______;并请画出在p2压强下(p2> p1)的曲线。
(4)在碱性条件下可将合成甲醇的反应设计成原电池,则负极的电极反应式为______。

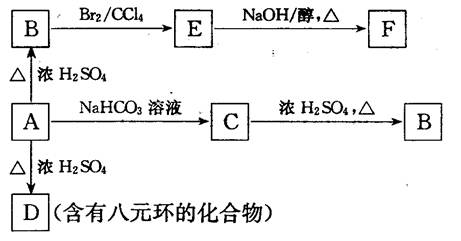
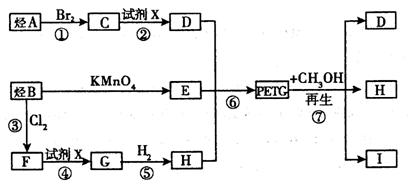
 则有机物A的结构简式是 。
则有机物A的结构简式是 。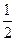 O2(g)===CO(g)+2H2(g);
O2(g)===CO(g)+2H2(g); CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号