(I)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg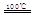 HgBr2+H2
HgBr2+H2
③HgBr2+_____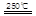 _____ + ④2HgO
_____ + ④2HgO 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:________ _。
根据“绿色化学”的思想评估该方法制H2的主要缺点:________ __。
(II)氢气常用生产水煤气的方法制得。CO(g)+H2O(g) CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K______1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3.0molH2O、1.0molCO2和x mol H2,则:
①当x = 5.0时,上述平衡向___________(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是__________。
(3)在850℃时,若x="5.0" mol,其它物质的投料不变,当上述反应达到平衡后,求H2的体积分数(计算结果保留两位有效数字)。
粤ICP备20024846号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
Copyright ©2020-2024 优题课 youtike.com 版权所有
Powered by:Youtike Platform 6.6.1
声明:本网站部分内容由互联网用户自发贡献自行上传,本网站不拥有所有权,也不承担相关法律责任。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
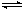 CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
CH3OH(g)+H2O(g),某些化学键的键能数据如下表: 离子的数目之比为 ;
离子的数目之比为 ;