菱镁矿是碱性耐火材料的主要原料,其主要的化学成分是:MgCO3,同时含有杂质:SiO2、Al2O3、Fe2O3、CaO等;目前以菱镁矿为主要原料制备MgSO4的方法如下: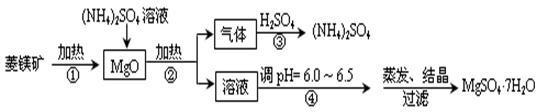
已知:①常温下,Fe3+、Al3+、Mg2+开始形成氢氧化物沉淀和沉淀完全时的pH值如下:
| |
Fe3+ |
Al3+ |
Mg2+ |
| 开始沉淀 |
2.1 |
3.7 |
9.0 |
| 沉淀完全 |
3.2 |
5.2 |
12.4 |
②MgSO4·7H2O在70~80℃时失去3个结晶水,300℃时失去全部的结晶水;
(1)用平衡原理解释:菱镁矿粉粹后加热生成的氧化镁可以溶解在硫酸铵溶液中的原因 。
(2)在该工业流程中,可以循环使用的物质是 。
(3)步骤③中氨气和硫酸恰好完全反应,取此时所得的溶液10.00mL配成250mL溶液,配制溶液过程中除烧杯、玻璃棒、胶头滴管、酸式滴定管外,还需要的玻璃仪器有: ;经检测所配制的溶液pH=1,c(SO42ˉ)=1.05mol/L,试求算所配制溶液中NH4+ 水解的平衡常数K(写计算过程,计算结果保留三位有效数字)。
(4)在加热条件下杂质中的三氧化二铁溶于硫酸铵的离子反应方程式是:
。
(5)蒸发结晶过程中需要使用60~70℃水浴加热方式,其原因是 。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号