某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。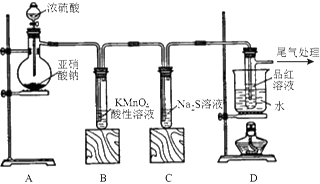
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是 ,A中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。




 粤公网安备 44130202000953号
粤公网安备 44130202000953号