工业上以碳素铬铁为原料制取铬铵矾,利用电解法制取金属铬。其工艺流程如下图所示。
已知:FeSO4+Cr=CrSO4+H2↑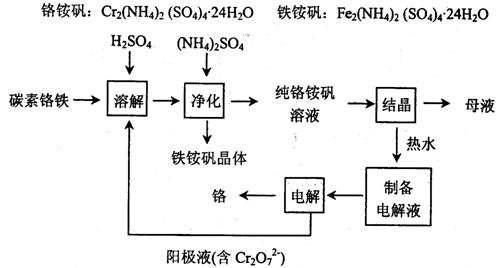
(1)碳素铬铁是铁铬合金,粉碎后溶于硫酸和电解阳极液的混合溶液中。该过程中电解阳极液的主要作用是 。
(2)加入(NH4)2SO4的目的是 。
(3)结晶后的母液从绿色化学的角度可采用的处理方法是 。
(4)产品铬中含氧呈脆性,为了降低其含氧量,可通过 提高其纯度。
工业上以碳素铬铁为原料制取铬铵矾,利用电解法制取金属铬。其工艺流程如下图所示。
已知:FeSO4+Cr=CrSO4+H2↑
(1)碳素铬铁是铁铬合金,粉碎后溶于硫酸和电解阳极液的混合溶液中。该过程中电解阳极液的主要作用是 。
(2)加入(NH4)2SO4的目的是 。
(3)结晶后的母液从绿色化学的角度可采用的处理方法是 。
(4)产品铬中含氧呈脆性,为了降低其含氧量,可通过 提高其纯度。