将下列物质进行分类:
①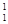 H与
H与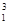 H ;
H ;
②O2与O3;
③乙醇(C2H5OH)与甲醚(CH3—O—CH3) ;
④正丁烷(CH3CH2 CH2 CH3)与异丁烷(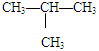 ) ,
) ,
⑤甲烷(CH4)与丙烷(C3H8)。
(1)互为同位素的是 (填序号、下同);
(2)互为同系物的是 ;
(3)互为同分异构体的是 。
将下列物质进行分类:
①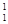 H与
H与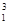 H ;
H ;
②O2与O3;
③乙醇(C2H5OH)与甲醚(CH3—O—CH3) ;
④正丁烷(CH3CH2 CH2 CH3)与异丁烷( ) ,
) ,
⑤甲烷(CH4)与丙烷(C3H8)。
(1)互为同位素的是 (填序号、下同);
(2)互为同系物的是 ;
(3)互为同分异构体的是 。