向20mL盐酸和硫酸的混合酸溶液中,渐渐加入
0.1mol/L的Ba(OH)2溶液。生成沉淀的质量和溶液的pH变化曲线如右图。根据此实验数据计算: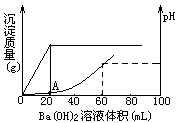
(1)原溶液中硫酸和盐酸的浓度各为多少_________________。
(2)A点处溶液的pH是______________。
向20mL盐酸和硫酸的混合酸溶液中,渐渐加入
0.1mol/L的Ba(OH)2溶液。生成沉淀的质量和溶液的pH变化曲线如右图。根据此实验数据计算:
(1)原溶液中硫酸和盐酸的浓度各为多少_________________。
(2)A点处溶液的pH是______________。