12.0 g某液态有机化合物A完全燃烧后,生成14.4 g H2O和26.4 gCO2。测得有机化合物A的蒸气对H2的相对密度是30,求: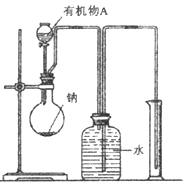
(1)有机物A的分子式 。
(2)用如图所示装置测定有机物A的分子结构,实验数据如下(实验数据均已换算为标准状况):a mL(密度为 )的有机物A与足量钠完全反应后,量筒液面读数为b mL,若1 molA分子中有x mol氢原子能跟金属钠反应,则x的计算式为 (可以不化简)。
)的有机物A与足量钠完全反应后,量筒液面读数为b mL,若1 molA分子中有x mol氢原子能跟金属钠反应,则x的计算式为 (可以不化简)。
12.0 g某液态有机化合物A完全燃烧后,生成14.4 g H2O和26.4 gCO2。测得有机化合物A的蒸气对H2的相对密度是30,求:
(1)有机物A的分子式 。
(2)用如图所示装置测定有机物A的分子结构,实验数据如下(实验数据均已换算为标准状况):a mL(密度为 )的有机物A与足量钠完全反应后,量筒液面读数为b mL,若1 molA分子中有x mol氢原子能跟金属钠反应,则x的计算式为 (可以不化简)。
)的有机物A与足量钠完全反应后,量筒液面读数为b mL,若1 molA分子中有x mol氢原子能跟金属钠反应,则x的计算式为 (可以不化简)。