硝酸工业的基础是氨的催化氧化,在催化剂作用下发生如下反应:
① 4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H = —905 kJ/mol ①主反应
4NO(g)+6H2O(g) △H = —905 kJ/mol ①主反应
② 4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H = —1268 kJ/mol ②副反应
2N2(g)+6H2O(g) △H = —1268 kJ/mol ②副反应
有关物质产率与温度的关系如甲图。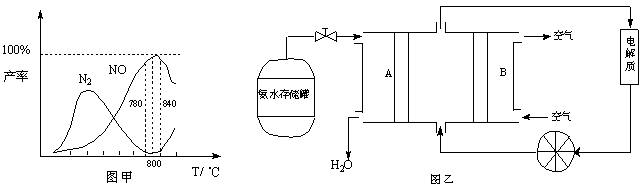
(1)由反应①②可知反应③N2(g) + O2(g) 2NO(g)的反应热ΔH= 。
2NO(g)的反应热ΔH= 。
(2)由图甲可知工业上氨催化氧化生成 NO时,反应温度最好控制在 。
(3)用Fe3O4制备Fe(NO3)3溶液时,需加过量的稀硝酸,原因一:将Fe4O3中的Fe2+全部转化为Fe3+,
原因二: (用文字和离子方程式说明)。
(4)将NH3通入NaClO溶液中,可生成N2H4,则反应的离子方程式为 。
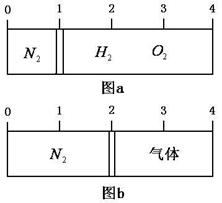
(5)依据反应②可以设计成直接供氨式碱性燃料电池(如乙图所示),则图中A为 (填“正极”或“负极”),电极方程式为 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号