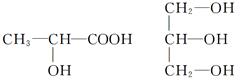按要求完成下列问题。
(1)写出Mg2+的电子排布式 。
(2)依次指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:________、________、________。
(3)判断BCl3分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角:________、________、________。
(4)下列分子中若有手性分子,请用“*”标出其手性碳原子。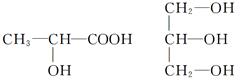
按要求完成下列问题。
(1)写出Mg2+的电子排布式 。
(2)依次指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:________、________、________。
(3)判断BCl3分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角:________、________、________。
(4)下列分子中若有手性分子,请用“*”标出其手性碳原子。