芳香族化合物A只有两个对位取代基,在一定条件下有如下图所示转化关系。其中,1 mol C与Na完全反应生成1 mol H2,若l mol C与NaHCO3完全反应,也产生l mol气体,E可以使溴的四氯化碳溶液褪色。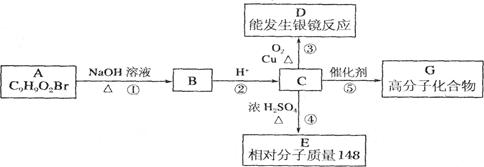
(1)D分子中的含氧官能团名称是___________,A的结构简式是___________。
(2)反应④的基本类型是_______反应,反应⑤的化学方程式是___________________________ 。
(3)与C取代基位置相同,既能与FeCl3溶液显色、又能发生水解反应的结构简式为: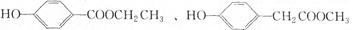 ,______________________、_____________________。(写两种即可)
,______________________、_____________________。(写两种即可)

 o
o

 L的 NaOH溶液完全反应,A中含有一个一COOH和一个一CH3,它可以与乙酸发生酯化反应;C在稀硫酸或稀氢氧化钠溶液中均能反应。完成下列填空:
L的 NaOH溶液完全反应,A中含有一个一COOH和一个一CH3,它可以与乙酸发生酯化反应;C在稀硫酸或稀氢氧化钠溶液中均能反应。完成下列填空: _____________________、______________
_____________________、______________
 小的元素是,原子半径最大的元素是
小的元素是,原子半径最大的元素是 单质是
单质是 粤公网安备 44130202000953号
粤公网安备 44130202000953号