华法林是一种治疗心脑血管疾病的药物,可由化合物和在一定条件下合成得到(部分反应条件略)
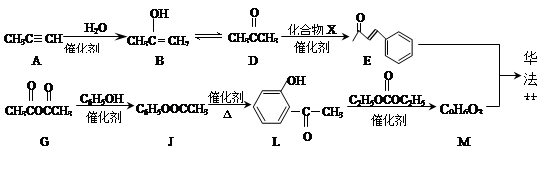
(1)的名称为,的反应类型为。
(2)的反应中,加入的化合物与新制反应产生砖红色沉淀的化学方程式为。
(3)为取代反应,其另一产物分子中的官能团是。
(4)的同分异构体是芳香酸,,的核磁共振氢谱只有两组峰,的结构简式为,的化学方程式为。
(5)图中,能缩合成体型高分子化合物的酚类单体是。

和 ,的结构简式为
,的结构简式为
华法林是一种治疗心脑血管疾病的药物,可由化合物和在一定条件下合成得到(部分反应条件略)

(1)的名称为,的反应类型为。
(2)的反应中,加入的化合物与新制反应产生砖红色沉淀的化学方程式为。
(3)为取代反应,其另一产物分子中的官能团是。
(4)的同分异构体是芳香酸,,的核磁共振氢谱只有两组峰,的结构简式为,的化学方程式为。
(5)图中,能缩合成体型高分子化合物的酚类单体是。

和 ,的结构简式为
,的结构简式为