常温下,如果取0.1mol·L-1HA溶液与0.1mol···L-1NaOH溶液等体积混合(不计混合后溶液体积的变化),测得混合液的pH=8,请回答下列问题:
(1)混合后溶液的pH=8的原因(用离子方程式表示): 。
(2)混合溶液中由水电离出的c(H+) (填<、>、=)0.1mol·L-1NaOH溶液中由水电离出的c(H+)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
C(Na+) -c(A-)= mol·L-1,c(OH-)-c(HA)= mol·L-1。
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填<、>、=);将同温下等物质的量浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2CO3 D.NH4Cl
按pH由大到小的顺序排列: (填序号)。
 反应反应热的测定。请回答下列问题:
反应反应热的测定。请回答下列问题:
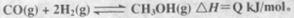 CO的转化率与温度、压强的关系如图所示。
CO的转化率与温度、压强的关系如图所示。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号