(17分)某反应A(g)+B(g) C(g)在任一时刻的正、逆反应速率可用υ正、υ逆表示:
C(g)在任一时刻的正、逆反应速率可用υ正、υ逆表示:
υ正=k1·c(A)·c(B),υ逆=k2·c(C),其中k1、k2在一定温度下为常数,c(A)、c(B)、c(C)分别代表某时刻三种物质的物质的量浓度。
(1)上述反应达到平衡时,请用题干中的符号分别表示三种物质的浓度关系为 ,
平衡常数K=_ __。
(2)在300 K时,开始反应的A、B浓度均为0.1 mol/L,达到平衡时B的转化率为50%,则k1、k2之间的关系是__________________。
(3)升高温度,k1的变化是 ,k2的变化是_________(填“增大”、“减小”或“不变”);此时若k1/k2增大,则说明正反应是___________(填“吸”或“放”)热反应。
(4) CO2可与H2合成绿色燃料甲醇。300oC时,在两个容积均为2L的密闭容器中,当c(CO2)=1.00 mol·L-1、c(H2)=1.60 mol·L-1时,分别选择催化剂Ⅰ、催化剂Ⅱ开始反应,t0时达到平衡状态M1、M2。若υ逆(M1)<υ正(M2)。且达M1时,CO2的转化率为20%,请画出两个状态的浓度商(Qc)-时间(t)的关系图像,并标明相关数据。
=
(5)实验室可利用甲醇、空气、铜(或氧化铜)制备甲醛。关于甲醇和甲醛的沸点和水溶性见下表:
|
沸点
|
水溶性
|
甲醇
|
65℃
|
与水相溶
|
甲醛
|
-21℃
|
与水相溶
|
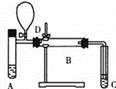
下图是某同学设计的实验装置,已知A处放入甲醇,C处收集到甲醛,若D处的气球在反应临近结束时使用,则B处应放入______(填化学式),请回答A、B、C三处采取控温的方式分别为A_____、B 、C ,(从下列选项中选择)
a.热水浴加热 b.冰水浴冷却 c.酒精灯加热 d.酒精喷灯灼烧 e.常温即可
实验临近结束时,挤压D处气球使空气进入装置,该操作的目的是____________________。