铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下图所示,请回答有关问题: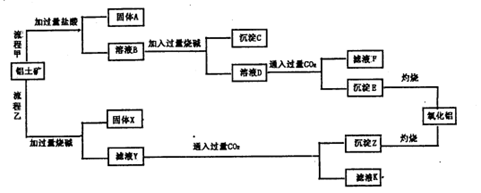
(1)流程乙加入烧碱后发生反应的离子方程式: .
(2)溶液D到沉淀E发生的离子方程式: 。
(3)验证滤液B含Fe3+,可取少量滤液并加入 。
(4)滤液K中溶质的主要成份是 (填化学式)。
铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下图所示,请回答有关问题:
(1)流程乙加入烧碱后发生反应的离子方程式: .
(2)溶液D到沉淀E发生的离子方程式: 。
(3)验证滤液B含Fe3+,可取少量滤液并加入 。
(4)滤液K中溶质的主要成份是 (填化学式)。