在2 L的密闭容器中,放入0.4 mol A和0.6 mol B,在一定温度下,压强为p,放入催化剂(体积忽略),发生反应2A(g)+3B(g)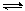 xC(g)+2D(g),在a min后,容器中c(A)=0. 1 mol·L-1,则a min内,v(B)=______ ______;若温度不变,压强变为0.9p,则v(C)=____ ___,x=_________。
xC(g)+2D(g),在a min后,容器中c(A)=0. 1 mol·L-1,则a min内,v(B)=______ ______;若温度不变,压强变为0.9p,则v(C)=____ ___,x=_________。
在2 L的密闭容器中,放入0.4 mol A和0.6 mol B,在一定温度下,压强为p,放入催化剂(体积忽略),发生反应2A(g)+3B(g)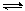 xC(g)+2D(g),在a min后,容器中c(A)=0. 1 mol·L-1,则a min内,v(B)=______ ______;若温度不变,压强变为0.9p,则v(C)=____ ___,x=_________。
xC(g)+2D(g),在a min后,容器中c(A)=0. 1 mol·L-1,则a min内,v(B)=______ ______;若温度不变,压强变为0.9p,则v(C)=____ ___,x=_________。