将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)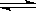 xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L.min)。试求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L.min)。试求:
(1)此时A的浓度为 ,反应开始前容器中A、B的物质的量为 ;
(2) B的平均反应速率为 ;
(3)x= 。
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)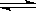 xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L.min)。试求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L.min)。试求:
(1)此时A的浓度为 ,反应开始前容器中A、B的物质的量为 ;
(2) B的平均反应速率为 ;
(3)x= 。