在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示。
问: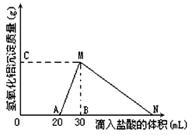
(1)此溶液中同时含有____mol___ 离子;
(2) C(或M)点的纵坐标为0.78,则c(AlO2-)为
(3) 点B的横坐标为30,则到点N处滴入的HCl溶液体积为 mL
在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示。
问:
(1)此溶液中同时含有____mol___ 离子;
(2) C(或M)点的纵坐标为0.78,则c(AlO2-)为
(3) 点B的横坐标为30,则到点N处滴入的HCl溶液体积为 mL