实验室常用仪器如下。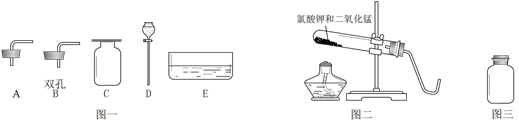
① 写出仪器名称 E (1) 。
② 请在图一中选择仪器完成下列实验(填仪器编号)
Ⅰ.用图二装置制取并收集氧气,还需要的仪器是 (2) 。
Ⅱ.将图三中的氧气导出,需要的仪器是(3) 。
③ 图一中的仪器能否组成随开随用、随关随停的气体发生装置? (4) 。(填“能”或“不能”)
④ 加热0.04 mol氯酸钾与一定量二氧化锰的混合物,最多可以得到多少克氧气?(根据化学方程式列式计算)
实验室常用仪器如下。
① 写出仪器名称 E (1) 。
② 请在图一中选择仪器完成下列实验(填仪器编号)
Ⅰ.用图二装置制取并收集氧气,还需要的仪器是 (2) 。
Ⅱ.将图三中的氧气导出,需要的仪器是(3) 。
③ 图一中的仪器能否组成随开随用、随关随停的气体发生装置? (4) 。(填“能”或“不能”)
④ 加热0.04 mol氯酸钾与一定量二氧化锰的混合物,最多可以得到多少克氧气?(根据化学方程式列式计算)