右图是常见固体物质的溶解度曲线,根据图示回答: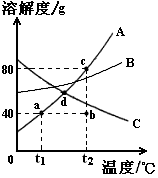
(1)对A物质来说,a点的意义是 。
(2)将t1℃140 g A的饱和溶液升温至t2℃时,此时溶液是 (填“饱和”或“不饱和”)状态,然后再加入A物质40 g,可用曲线上的 点表示。t2℃时A、B、C三种物质饱和溶液的质量分数由大到小的顺序是 。
(3)若将d点温度下A、B、C三种物质的饱和溶液降温至t1℃,没有晶体析出的是 物质。
右图是常见固体物质的溶解度曲线,根据图示回答:
(1)对A物质来说,a点的意义是 。
(2)将t1℃140 g A的饱和溶液升温至t2℃时,此时溶液是 (填“饱和”或“不饱和”)状态,然后再加入A物质40 g,可用曲线上的 点表示。t2℃时A、B、C三种物质饱和溶液的质量分数由大到小的顺序是 。
(3)若将d点温度下A、B、C三种物质的饱和溶液降温至t1℃,没有晶体析出的是 物质。