在实验室我们也可以用下图所示的装置制取乙酸乙酯。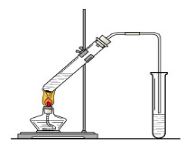
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是 。
(2)写出制取乙酸乙酯的化学方程式 。
(3)饱和碳酸钠溶液的主要作用除了吸收乙酸和乙醇外,还有 。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,其目的是 。
(5)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 。
在实验室我们也可以用下图所示的装置制取乙酸乙酯。
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是 。
(2)写出制取乙酸乙酯的化学方程式 。
(3)饱和碳酸钠溶液的主要作用除了吸收乙酸和乙醇外,还有 。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,其目的是 。
(5)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 。