使用化石燃料的汽车在给人类带来便利的同时,其排放出的尾气也会污染环境,降低汽车尾气有害成份是减轻大气污染的重要途径;研制开发使用新型能源的汽车更具有现实意义。
(1)已知下列热化学方程式:
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
N2 (g)+O2(g)=2NO(g) ΔH=+27kJ·mol-1
加装有催化转化器的汽车尾气排放时反应方程式为:2NO(g)+2CO(g) N2(g)+2CO2(g) ,该反应的ΔH为________;假设此变化过程热量变化共有59.3kJ,则转移的电子为______NA(NA表示阿伏加德罗常数)。
N2(g)+2CO2(g) ,该反应的ΔH为________;假设此变化过程热量变化共有59.3kJ,则转移的电子为______NA(NA表示阿伏加德罗常数)。
(2)某科研机构在实验室中对NO、CO之间的反应进行了探究:他们将2molNO、1molCO充入一个1L固定容积的容器中,测出反应过程中各物质的浓度变化并绘制成右图(0~15min内)
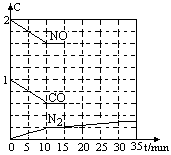
①此温度下该反应的平衡常数为__________;15min时,改变某种条件后c(N2)变化如右图(15min~35min)所示,则改变的条件可能是____
a.降低温度 b.缩小容器容积
c.增加CO2的量 d.升高温度
②若N2在0~5分钟、10~15分钟、15~30、30~35分钟的平均反应速率分别记为 (0~5)、
(0~5)、 (10~15)、
(10~15)、 (15~30)、
(15~30)、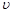 (30~35)。四者之间的大小关系为________________,
(30~35)。四者之间的大小关系为________________,
③若保持温度不变,在12min时再向容器中充入CO、N2各0.6mol,则平衡将___________移动(填“向左”、“向右”、“不”)。
(3)高铁电池具有能量密度高、原料丰富成本低廉,绿色无污染不需要回收等特点,它己成为电动汽车首选的电池,其工作原理为:3Zn+2K2FeO4+8H2O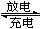 3Zn(OH)2+4KOH
3Zn(OH)2+4KOH
+2Fe(OH)3。则放电时,负极材料是________,正极上的电极反应式为_________________充电时阴极附近溶液pH_______(填增大、减小、不变)。
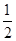 O2(g)=CO2(g) ΔH2=b kJ·mol-1
O2(g)=CO2(g) ΔH2=b kJ·mol-1 2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为p0,反应过程中压强用p表示,反应过程中
2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为p0,反应过程中压强用p表示,反应过程中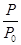 与时间t的关系如图所示。
与时间t的关系如图所示。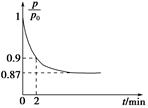
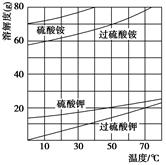
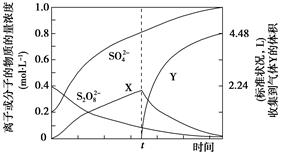
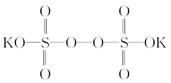 )具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
)具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下: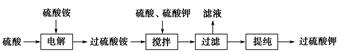
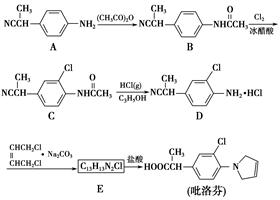

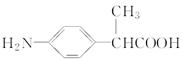 )。写出同时满足下列条件的F的两种同分异构体的结构简式_____________________________。
)。写出同时满足下列条件的F的两种同分异构体的结构简式_____________________________。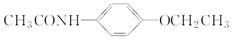 ,写出以苯酚钠、CH3CH2OH和(CH3CO)2O为原料制备非那西汀的合成路线流程图(无机试剂任用) 。合成路线流程图示例如下:
,写出以苯酚钠、CH3CH2OH和(CH3CO)2O为原料制备非那西汀的合成路线流程图(无机试剂任用) 。合成路线流程图示例如下: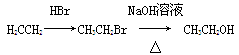

 BaS(s)+4CO2(g),该反应的平衡常数的表达式为__________________________________________________。
BaS(s)+4CO2(g),该反应的平衡常数的表达式为__________________________________________________。 粤公网安备 44130202000953号
粤公网安备 44130202000953号