从某些植物树叶提取的挥发油中含有下列主要成分:
(1)写出A的分子式 ,C的含氧官能团名称为 。
(2)1molB与溴水充分反应,需消耗 mol单质溴。
(3)写出C在一定条件下与足量H2反应的化学方程式: 。
(4)已知: 写出C在强氧化剂条件下生成的有机化合物的结构简式 。
写出C在强氧化剂条件下生成的有机化合物的结构简式 。
(5)写出A和B在一定条件下反应,生成高分子化合物的化学方程式:
。
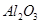 ,含
,含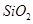 、
、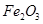 等杂质)中提取氧化铝的工艺做实验,流程如下:
等杂质)中提取氧化铝的工艺做实验,流程如下: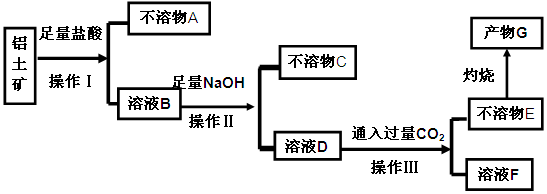

 粤公网安备 44130202000953号
粤公网安备 44130202000953号