MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO2和MnCO3)样品转化为纯MnO2实验,其流程如下: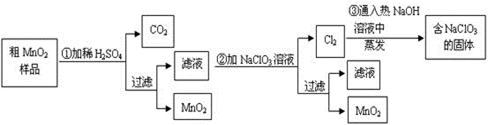
(1)第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式
+ ClO3-+ = MnO2↓+ + 。
(3)已知第③步蒸发得到的固体中有NaClO3和NaOH,则一定还有含有 (写化学式)。
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO2和MnCO3)样品转化为纯MnO2实验,其流程如下:
(1)第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式
+ ClO3-+ = MnO2↓+ + 。
(3)已知第③步蒸发得到的固体中有NaClO3和NaOH,则一定还有含有 (写化学式)。