下图中的几种仪器装置都可以制得氢气,其中: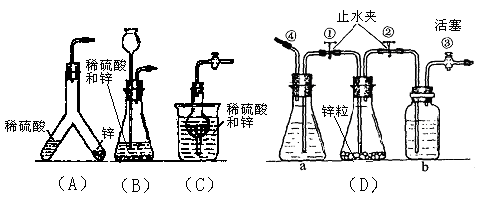
(1)能使发生或停止发生氢气操作均比较方便的装置是(写编号) ,能够灌充升空的小氢气球的装置是 。
(2)在(D)装置中a中的液体应是 ;b中的液体应是 ,其作用是 。
(3)使(D)装置发生氢气的操作顺序应该是 。
下图中的几种仪器装置都可以制得氢气,其中:
(1)能使发生或停止发生氢气操作均比较方便的装置是(写编号) ,能够灌充升空的小氢气球的装置是 。
(2)在(D)装置中a中的液体应是 ;b中的液体应是 ,其作用是 。
(3)使(D)装置发生氢气的操作顺序应该是 。