(1)下面框图中,A是空气中的一种主要成分,C的相对分子质量比B的大16,D是酸。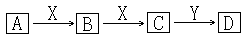
其中A、B、C、D均含有同一元素,请确认B是 ,X是 ,Y是 。
(2)新制的氯水中存在Cl2、H2O、HClO、HCl,其中能起杀菌消毒作用的是 ,能与硝酸和硝酸银的混合液作用生成白色沉淀的是 ,能使染料和有机色质褪色的是 。
(1)下面框图中,A是空气中的一种主要成分,C的相对分子质量比B的大16,D是酸。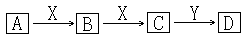
其中A、B、C、D均含有同一元素,请确认B是 ,X是 ,Y是 。
(2)新制的氯水中存在Cl2、H2O、HClO、HCl,其中能起杀菌消毒作用的是 ,能与硝酸和硝酸银的混合液作用生成白色沉淀的是 ,能使染料和有机色质褪色的是 。