随着现代工业的发展,能源问题已经越来越引起人们的重视,科学家预言,未来理想的燃料是绿色植物,即将植物的秸秆(主要成分是纤维素)与适当的催化剂作用水解成葡萄糖,再将葡萄糖转化为乙醇,用作燃料。
(1)写出绿色植物秸秆转化为乙醇的化学方程式:
①___________________________________,②______________________________________。
(2)乙醇除用作燃料外,还可以用它合成其他有机物。下列主要是以乙醇为起始原料的转化关系图,请在表中填上相应物质的结构简式。
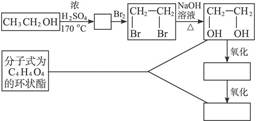
(3)写出上述转化关系图由
CH2OHCH2OH C4H4O4的化学方程式(有机物用结构简式表示)。
C4H4O4的化学方程式(有机物用结构简式表示)。