(1)在室温下测得0.1mol·L-1氨水PH=11,则该温度下氨水的电离度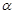 =__________
=__________
(2)25℃时在0.1mol·L-1的H2A水溶液中,用氢氧化钠来调节溶液的pH,得到其中含H2A、HA-、A2-三种微粒的溶液。
①当溶液的pH=7时,c(Na+)=__________(填微粒间量的关系)
②当c(Na+)=c(A2-)+c(HA-)+c(H2A)时溶液为__________溶液(填物质)。
(3)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和液态水,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是__________。
(4)甲醇—空气燃料电池是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:2CH3OH+3O2=2CO2+4H2O。其工作原理示意图如下(其中a、b、c、d四个出入口表示通入或排出的物质)。
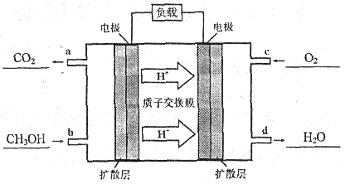
则负极的电极反应式为__________;正极的电极反应式为__________