某可逆反应在0—2分钟的进行过程中, 在不同反应时间各物质的量的变化情况如右图所示。则该反应的反应物是 ,生成物是 ,此反应 (填“是”或“不是”)可逆反应;反应开始至2分钟时, (填“能”或“不能”)用C表示反应速率,2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 状态,此时正反应速率 (填 “等于”或“不等于”) 逆反应速率。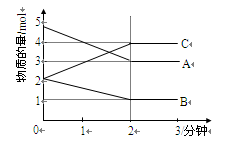
某可逆反应在0—2分钟的进行过程中, 在不同反应时间各物质的量的变化情况如右图所示。则该反应的反应物是 ,生成物是 ,此反应 (填“是”或“不是”)可逆反应;反应开始至2分钟时, (填“能”或“不能”)用C表示反应速率,2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 状态,此时正反应速率 (填 “等于”或“不等于”) 逆反应速率。