现有下列高分子化合物,请从下列各项中选择出最恰当的选项,将代号填入下表。
(1)高分子结构型式示意图: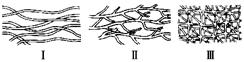
(2)高分子材料的主要性质特点:
| A.具有热塑性 |
| B.可溶于有机溶剂 |
| C.不溶于有机溶剂 |
| D.具有确定的熔点 |
(3)主要应用:(a)用于制备塑料薄膜;(b)用于制备光学仪器;(c)用于制备车辆轮胎
| |
硫化橡胶 |
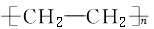 |
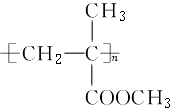 |
| (1) |
|
|
|
| (2) |
|
|
|
| (3) |
|
|
|
现有下列高分子化合物,请从下列各项中选择出最恰当的选项,将代号填入下表。
(1)高分子结构型式示意图:
(2)高分子材料的主要性质特点:
| A.具有热塑性 |
| B.可溶于有机溶剂 |
| C.不溶于有机溶剂 |
| D.具有确定的熔点 |
(3)主要应用:(a)用于制备塑料薄膜;(b)用于制备光学仪器;(c)用于制备车辆轮胎
| |
硫化橡胶 |
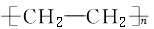 |
 |
| (1) |
|
|
|
| (2) |
|
|
|
| (3) |
|
|
|